


新闻资讯
纳米囊泡表面修饰调控蛋白冠组成提高药物递送效率
2024-04-07 17:46
2024年1月18日,中科环渤海(烟台)药物高等研究院张馨欣研究员及中国科学院上海药物研究所甘勇研究员共同在Nature Communications发表题为“Regulating protein corona on nanovesicles by glycosylated polyhydroxy polymer modification for efficient drug delivery”的研究论文。该研究通过构建不同氨基/羟基比的糖基化多羟基聚合物修饰的纳米囊泡(CP-LVs),探究纳米囊泡表面修饰在蛋白冠形成及药物递送中的作用。研究发现氨基/羟基比约为0.4的CP-LVs(CP1-LVs)可有效抑制血液和肝脏中免疫球蛋白的吸附,延长血液循环;同时,通过吸附肿瘤间质液中丰富的肿瘤特异性蛋白(如CD44和骨桥蛋白),促进肿瘤细胞摄取,提高药物的肿瘤递送效率。

该研究中,采用了不同比例的PEO-PPO-PEO和壳寡糖连接设计一系列糖基化多羟基聚合物,制备了具有不同氨基/羟基比的纳米囊泡(CP-LVs)(图1)。经Boehm滴定及飞行时间二次离子质谱技术分析,验证了CP1-LVs、CP2-LVs和CP4-LVs表面修饰了不同比例的氨基/羟基结构,可用于探究不同表面基团分布对纳米载体表面蛋白冠组成的影响(图2)。
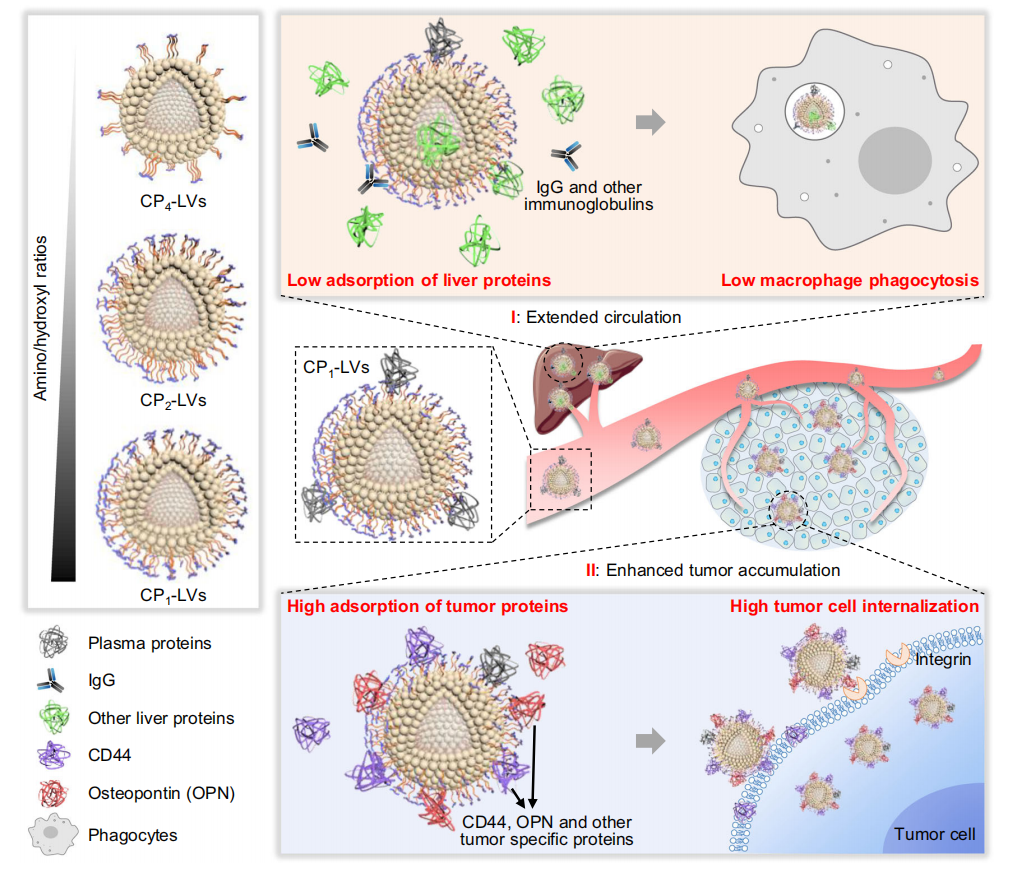
图1纳米囊泡表面的动态蛋白冠组成和蛋白冠影响的体内行为
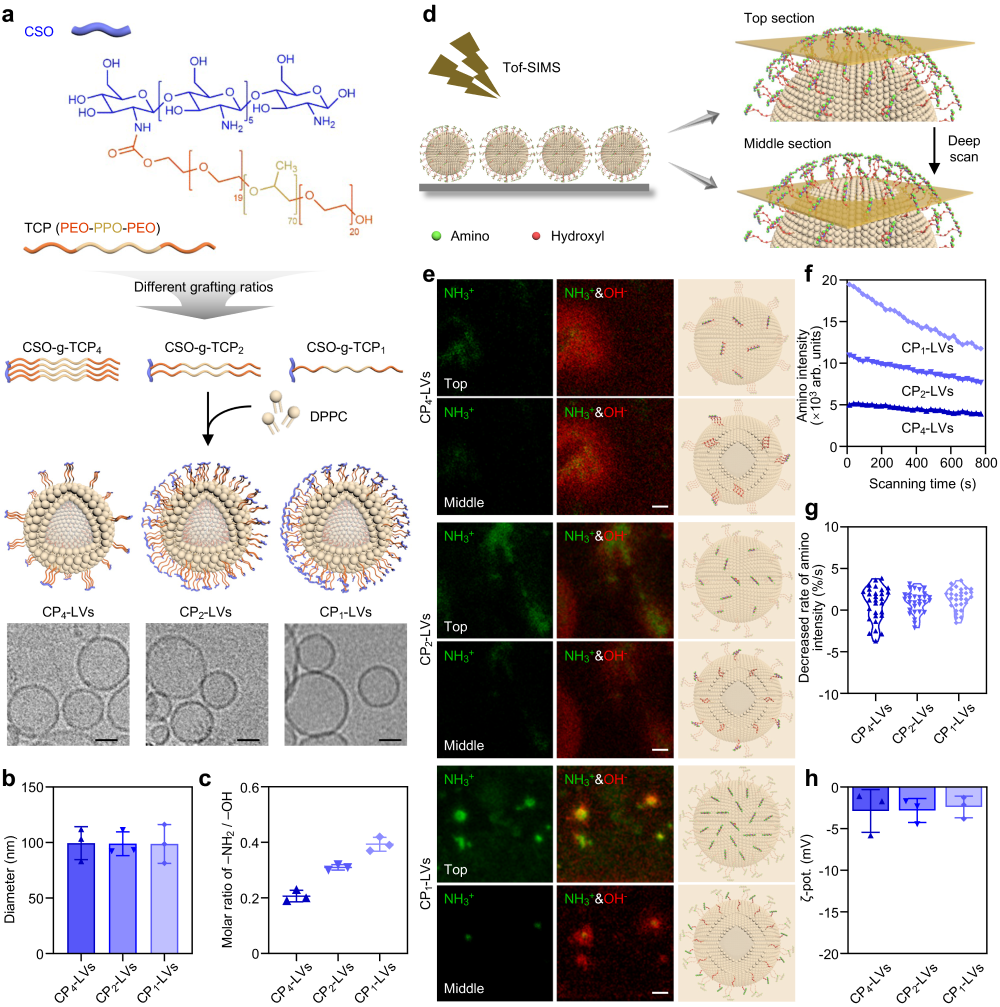
图2 不同氨基/羟基比的CP-LVs的制备及表征
在该研究中,通过体外模拟纳米囊泡从血液转运到肝脏的过程,研究不同氨基/羟基比对CP-LVs在血浆和肝间质液中蛋白质动态吸附的影响。随着表面氨基/羟基比的增加,CP-LVs吸附的蛋白质含量呈下降趋势;其中,CP1-LVs与血浆代表性蛋白(白蛋白)和肝间质液代表性蛋白(IgG)的结合亲和常数最低,在血浆和肝间质液中的蛋白质吸附量最低,显著降低了血液单核细胞J774和肝脏巨噬细胞Kupffer细胞的摄取水平,有利于延长血液循环。此外,CP1-LVs可显著降低其诱导的血浆anti-PEG水平,缓解多次给药产生的ABC效应。
在纳米囊泡从血液转运到肿瘤组织的过程中,CP1-LVs可大量结合肿瘤间质液中的蛋白质,包括细胞骨架蛋白、细胞膜蛋白、细胞外基质蛋白和代谢酶等。其中,肿瘤特异性蛋白CD44和OPN可在生理环境中通过静电作用结合在CP1-LVs表面。CP1-LVs可通过OPN和肿瘤细胞表面高表达的整合素受体结合、以及肿瘤细胞膜表面高表达的CD44介导的途径入胞,促进其在肿瘤细胞中的摄取。包载紫杉醇(PTX)的CP1-LVs(PTX@CP1-LVs)可高效抑制A549细胞和HeLa细胞的增殖。CP1-LVs可通过延长血液循环和增强肿瘤细胞摄取,提高了药物在肿瘤组织中的递送效率。研究以A549肺癌和HeLa宫颈癌为模型,评价了PTX@CP1-LVs的抗肿瘤药效。与常见的阳性对照组长循环紫杉醇脂质体(PTX@PEG-Lips)相比,PTX@CP1-LVs对肿瘤的抑制显著增强,其肿瘤抑制率高于90%,并延长荷瘤小鼠的生存周期。
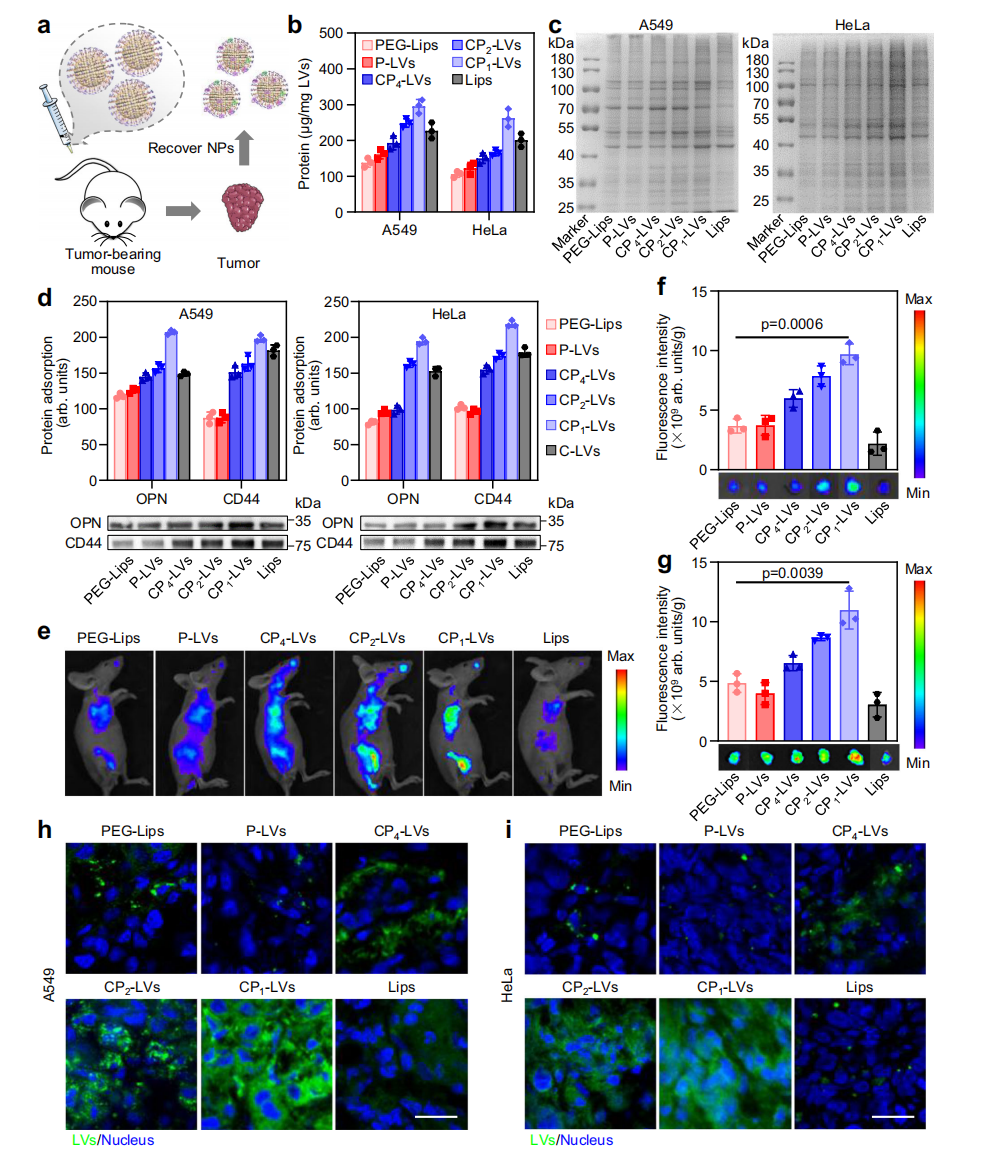
图3 肿瘤中纳米囊泡的蛋白冠的组成和积累
本研究探究表面不同氨基/羟基比的纳米囊泡对体内蛋白冠组成及后续对体内行为的影响,并筛选出可合理调控蛋白冠组成,实现长循环和高肿瘤细胞摄取的优势纳米囊泡(CP1-LVs)。这项研究可能为开发一种高度创新和转化的肿瘤治疗方法提供思路。更重要的是,本工作提出了精细调整功能基团比例和空间分布的概念,以合理设计纳米载体表面性质,控制纳米载体表面的蛋白冠组成,实现有效的药物递送。
中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室张馨欣研究员和中国科学院上海药物研究所甘勇研究员为通讯作者。博士后缪云秋为本论文的第一作者。本研究受到国家自然科学基金、中国博士后科学基金、上海市自然科学基金、新药研究国家重点实验室等项目资助。
文章链接:
https://doi.org/10.1038/s41467-024-45254-7
供稿部门:张馨欣课题组
纳米囊泡表面修饰调控蛋白冠组成提高药物递送效率
2024-04-07 17:46
2024年1月18日,中科环渤海(烟台)药物高等研究院张馨欣研究员及中国科学院上海药物研究所甘勇研究员共同在Nature Communications发表题为“Regulating protein corona on nanovesicles by glycosylated polyhydroxy polymer modification for efficient drug delivery”的研究论文。该研究通过构建不同氨基/羟基比的糖基化多羟基聚合物修饰的纳米囊泡(CP-LVs),探究纳米囊泡表面修饰在蛋白冠形成及药物递送中的作用。研究发现氨基/羟基比约为0.4的CP-LVs(CP1-LVs)可有效抑制血液和肝脏中免疫球蛋白的吸附,延长血液循环;同时,通过吸附肿瘤间质液中丰富的肿瘤特异性蛋白(如CD44和骨桥蛋白),促进肿瘤细胞摄取,提高药物的肿瘤递送效率。

该研究中,采用了不同比例的PEO-PPO-PEO和壳寡糖连接设计一系列糖基化多羟基聚合物,制备了具有不同氨基/羟基比的纳米囊泡(CP-LVs)(图1)。经Boehm滴定及飞行时间二次离子质谱技术分析,验证了CP1-LVs、CP2-LVs和CP4-LVs表面修饰了不同比例的氨基/羟基结构,可用于探究不同表面基团分布对纳米载体表面蛋白冠组成的影响(图2)。

图1纳米囊泡表面的动态蛋白冠组成和蛋白冠影响的体内行为

图2 不同氨基/羟基比的CP-LVs的制备及表征
在该研究中,通过体外模拟纳米囊泡从血液转运到肝脏的过程,研究不同氨基/羟基比对CP-LVs在血浆和肝间质液中蛋白质动态吸附的影响。随着表面氨基/羟基比的增加,CP-LVs吸附的蛋白质含量呈下降趋势;其中,CP1-LVs与血浆代表性蛋白(白蛋白)和肝间质液代表性蛋白(IgG)的结合亲和常数最低,在血浆和肝间质液中的蛋白质吸附量最低,显著降低了血液单核细胞J774和肝脏巨噬细胞Kupffer细胞的摄取水平,有利于延长血液循环。此外,CP1-LVs可显著降低其诱导的血浆anti-PEG水平,缓解多次给药产生的ABC效应。
在纳米囊泡从血液转运到肿瘤组织的过程中,CP1-LVs可大量结合肿瘤间质液中的蛋白质,包括细胞骨架蛋白、细胞膜蛋白、细胞外基质蛋白和代谢酶等。其中,肿瘤特异性蛋白CD44和OPN可在生理环境中通过静电作用结合在CP1-LVs表面。CP1-LVs可通过OPN和肿瘤细胞表面高表达的整合素受体结合、以及肿瘤细胞膜表面高表达的CD44介导的途径入胞,促进其在肿瘤细胞中的摄取。包载紫杉醇(PTX)的CP1-LVs(PTX@CP1-LVs)可高效抑制A549细胞和HeLa细胞的增殖。CP1-LVs可通过延长血液循环和增强肿瘤细胞摄取,提高了药物在肿瘤组织中的递送效率。研究以A549肺癌和HeLa宫颈癌为模型,评价了PTX@CP1-LVs的抗肿瘤药效。与常见的阳性对照组长循环紫杉醇脂质体(PTX@PEG-Lips)相比,PTX@CP1-LVs对肿瘤的抑制显著增强,其肿瘤抑制率高于90%,并延长荷瘤小鼠的生存周期。

图3 肿瘤中纳米囊泡的蛋白冠的组成和积累
本研究探究表面不同氨基/羟基比的纳米囊泡对体内蛋白冠组成及后续对体内行为的影响,并筛选出可合理调控蛋白冠组成,实现长循环和高肿瘤细胞摄取的优势纳米囊泡(CP1-LVs)。这项研究可能为开发一种高度创新和转化的肿瘤治疗方法提供思路。更重要的是,本工作提出了精细调整功能基团比例和空间分布的概念,以合理设计纳米载体表面性质,控制纳米载体表面的蛋白冠组成,实现有效的药物递送。
中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室张馨欣研究员和中国科学院上海药物研究所甘勇研究员为通讯作者。博士后缪云秋为本论文的第一作者。本研究受到国家自然科学基金、中国博士后科学基金、上海市自然科学基金、新药研究国家重点实验室等项目资助。
文章链接:
https://doi.org/10.1038/s41467-024-45254-7
供稿部门:张馨欣课题组