


新闻资讯
Cell Res | 揭示GPR30受体全新激活机制,挑战传统雌激素膜受体观念
2024-05-17 22:47
2024年5月14日,中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室谢欣团队联合中国科学院上海药物研究所徐华强和杨德华团队在Cell Research上发表了最新的研究成果,题为《Structural and functional evidence that GPR30 is not a direct estrogen receptor》。研究团队结合结构生物学和生化、细胞实验等多方面的证据,证明GPR30并非直接雌激素受体。这一发现不仅颠覆了之前的假设,也为我们对雌激素信号传导机制的理解提出了新的挑战和机遇。

雌激素作为一种关键激素,在人类生理学中发挥着至关重要的作用,涉及生殖功能、心血管健康和骨骼完整性等多个方面的生物过程。过去,GPR30作为一个孤儿受体,曾被假定为G蛋白偶联的雌激素受体,能够直接与雌激素结合,从而解释雌激素信号的非基因组效应和组织选择性。这一假设引起了广泛关注和讨论,对人们理解雌激素的快速生物学作用产生了深远影响。然而随着研究的深入,一些研究结果对GPR30作为雌激素受体这一假设产生了质疑,并且GPR30与雌激素的直接结合,并介导下游信号传导仍缺乏确切证据。
在该项研究中,研究人员首先利用单颗粒冷冻电镜手段研究雌激素及其类似物与GPR30的直接结合。他们利用17β-雌二醇(E2)以及两种报道的雌激素类似物氟维司群(fulvestrant)和G-1分别激活GPR30并结合下游G蛋白复合物的高分辨三维结构。在得到的三个GPR30的结构中,GPR30结构呈现出典型的GPCR激活状态,但是结合口袋中却没有观察到配体密度(图 1a)。因此研究人员又解析了GPR30在没有配体结合状态下的高分辨冷冻电镜结构,结构比对结果表明,无论是否添加雌激素及其类似物,GPR30的结构高度相似(图 1b)。
值得注意的是,研究人员发现GPR30配体结合口袋具有较强的亲水性,富含负电荷的氨基酸残基(图 1c),这与容纳疏水性雌激素配体的假设相冲突。此外,GPR30 的配体结合口袋明显比类固醇相关配体的结合口袋大得多。这些实验结果表明,GPR30可能不是一直以来认为的雌激素膜受体。
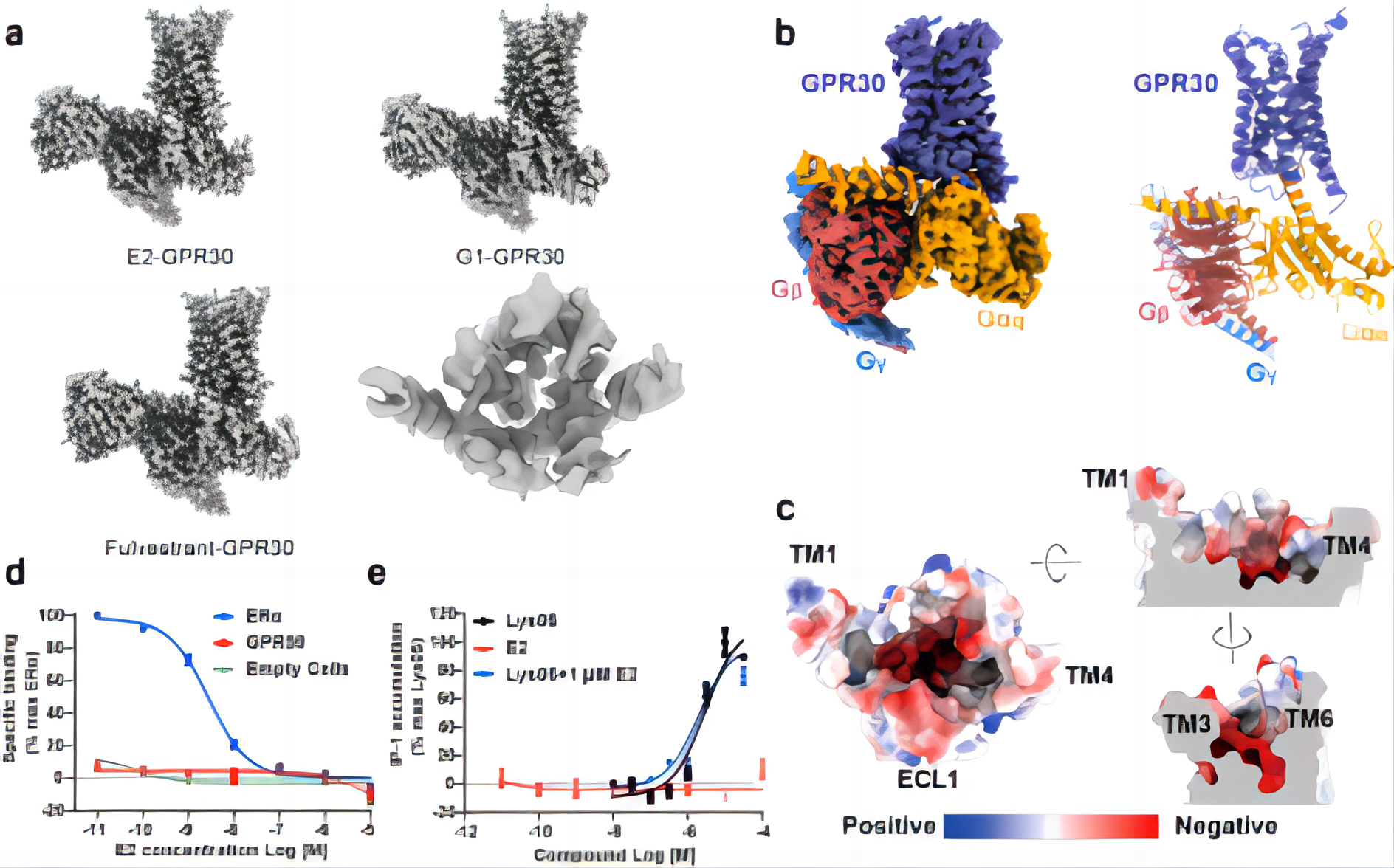
图1,a,GPR30在雌激素及其类似物的存在下的冷冻电镜结构和配体结合口袋;b,apo-GPR30的结构;c,GPR30的配体结合口袋富含负电荷的氨基酸;d-e,放射性配体结合试验(d)和细胞实验(e)表明E2不能激活GPR30并引起下游信号变化。
同时,研究人员利用放射性配体结合试验检测E2或其衍生物是否能够与GPR30直接结合。实验结果表明,GPR30与雌激素或者相关的配体,如他莫昔芬和雷洛昔芬,缺乏直接的相互作用(图 1d)。并且即使在高浓度实验条件下,E2在过表达GPR30的细胞系中也无法引起cAMP或IP1的变化,这表明它不会激活GPR30并引起下游信号通路,而带有多个正电氮原子为特征的小分子Lys05能够激活GPR30并引起下游Gq通路信号变化(图 1e),确认了亲水性激动剂如Lys05是GPR30的真正激活剂。这些数据也进一步的表明,GPR30不是雌激素受体。
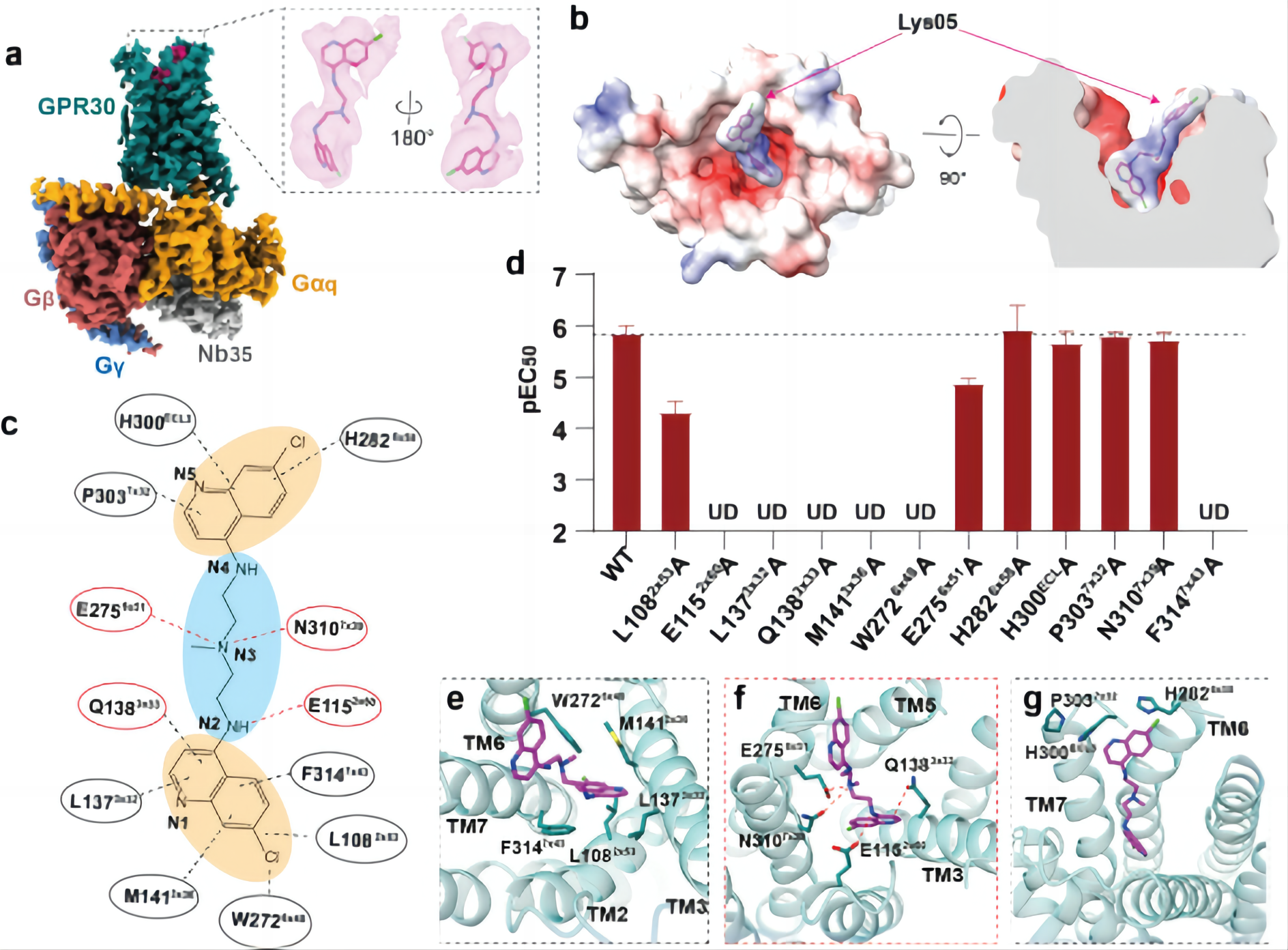
图2,a-b,Lys05-GPR30-Gq复合物的冷冻电镜结构(a)和原子模型(b);c,Lys05与GPR30相互作用的分子机制模式图;d,功能试验验证关键氨基酸突变对Lys05激活GPR30的影响;e-g,Lys05与GPR30配体结合口袋的氨基酸的相互作用。
研究团队进一步解析了Lys05激活GPR30的复合物高分辨结构(图 2a-b),结构分析提供了Lys05识别GPR30受体,并与受体结合的分子机制,揭示了Lys05分子结构中带正电的氮原子是识别GPR30的关键因素(图 2 c-g )。研究人员还探讨了GPR30受体自激活以及配体激活的潜在机制,为理解GPR30的结构药理学研究提供基础。
综上而言,该研究成果通过多种证据证明GPR30不是雌激素受体的直接受体,这将有助于进一步理解雌激素的生物学作用,为更深入地了解雌激素的生物学功能提供了新的视角。同时GPR3在多种生理和病理过程中发挥着重要作用,包括心血管功能、炎症反应、代谢调控等。因此,对GPR30的深入研究将有助于我们更好地理解这些过程,并为相关疾病的治疗提供新的策略。
中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室谢欣研究员以及中国科学院上海药物研究所徐华强、杨德华研究员为共同通讯作者。该项研究获得了包括中国科技部、国家自然科学基金、上海市科技重大专项、中科院战略性先导科技专项等经费的资助。
文章链接:https://www.nature.com/articles/s41422-024-00963-y
(供稿部门:谢欣课题组)
Cell Res | 揭示GPR30受体全新激活机制,挑战传统雌激素膜受体观念
2024-05-17 22:47
2024年5月14日,中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室谢欣团队联合中国科学院上海药物研究所徐华强和杨德华团队在Cell Research上发表了最新的研究成果,题为《Structural and functional evidence that GPR30 is not a direct estrogen receptor》。研究团队结合结构生物学和生化、细胞实验等多方面的证据,证明GPR30并非直接雌激素受体。这一发现不仅颠覆了之前的假设,也为我们对雌激素信号传导机制的理解提出了新的挑战和机遇。

雌激素作为一种关键激素,在人类生理学中发挥着至关重要的作用,涉及生殖功能、心血管健康和骨骼完整性等多个方面的生物过程。过去,GPR30作为一个孤儿受体,曾被假定为G蛋白偶联的雌激素受体,能够直接与雌激素结合,从而解释雌激素信号的非基因组效应和组织选择性。这一假设引起了广泛关注和讨论,对人们理解雌激素的快速生物学作用产生了深远影响。然而随着研究的深入,一些研究结果对GPR30作为雌激素受体这一假设产生了质疑,并且GPR30与雌激素的直接结合,并介导下游信号传导仍缺乏确切证据。
在该项研究中,研究人员首先利用单颗粒冷冻电镜手段研究雌激素及其类似物与GPR30的直接结合。他们利用17β-雌二醇(E2)以及两种报道的雌激素类似物氟维司群(fulvestrant)和G-1分别激活GPR30并结合下游G蛋白复合物的高分辨三维结构。在得到的三个GPR30的结构中,GPR30结构呈现出典型的GPCR激活状态,但是结合口袋中却没有观察到配体密度(图 1a)。因此研究人员又解析了GPR30在没有配体结合状态下的高分辨冷冻电镜结构,结构比对结果表明,无论是否添加雌激素及其类似物,GPR30的结构高度相似(图 1b)。
值得注意的是,研究人员发现GPR30配体结合口袋具有较强的亲水性,富含负电荷的氨基酸残基(图 1c),这与容纳疏水性雌激素配体的假设相冲突。此外,GPR30 的配体结合口袋明显比类固醇相关配体的结合口袋大得多。这些实验结果表明,GPR30可能不是一直以来认为的雌激素膜受体。

图1,a,GPR30在雌激素及其类似物的存在下的冷冻电镜结构和配体结合口袋;b,apo-GPR30的结构;c,GPR30的配体结合口袋富含负电荷的氨基酸;d-e,放射性配体结合试验(d)和细胞实验(e)表明E2不能激活GPR30并引起下游信号变化。
同时,研究人员利用放射性配体结合试验检测E2或其衍生物是否能够与GPR30直接结合。实验结果表明,GPR30与雌激素或者相关的配体,如他莫昔芬和雷洛昔芬,缺乏直接的相互作用(图 1d)。并且即使在高浓度实验条件下,E2在过表达GPR30的细胞系中也无法引起cAMP或IP1的变化,这表明它不会激活GPR30并引起下游信号通路,而带有多个正电氮原子为特征的小分子Lys05能够激活GPR30并引起下游Gq通路信号变化(图 1e),确认了亲水性激动剂如Lys05是GPR30的真正激活剂。这些数据也进一步的表明,GPR30不是雌激素受体。

图2,a-b,Lys05-GPR30-Gq复合物的冷冻电镜结构(a)和原子模型(b);c,Lys05与GPR30相互作用的分子机制模式图;d,功能试验验证关键氨基酸突变对Lys05激活GPR30的影响;e-g,Lys05与GPR30配体结合口袋的氨基酸的相互作用。
研究团队进一步解析了Lys05激活GPR30的复合物高分辨结构(图 2a-b),结构分析提供了Lys05识别GPR30受体,并与受体结合的分子机制,揭示了Lys05分子结构中带正电的氮原子是识别GPR30的关键因素(图 2 c-g )。研究人员还探讨了GPR30受体自激活以及配体激活的潜在机制,为理解GPR30的结构药理学研究提供基础。
综上而言,该研究成果通过多种证据证明GPR30不是雌激素受体的直接受体,这将有助于进一步理解雌激素的生物学作用,为更深入地了解雌激素的生物学功能提供了新的视角。同时GPR3在多种生理和病理过程中发挥着重要作用,包括心血管功能、炎症反应、代谢调控等。因此,对GPR30的深入研究将有助于我们更好地理解这些过程,并为相关疾病的治疗提供新的策略。
中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室谢欣研究员以及中国科学院上海药物研究所徐华强、杨德华研究员为共同通讯作者。该项研究获得了包括中国科技部、国家自然科学基金、上海市科技重大专项、中科院战略性先导科技专项等经费的资助。
文章链接:https://www.nature.com/articles/s41422-024-00963-y
(供稿部门:谢欣课题组)