


新闻资讯
APSB | 共载乐伐替尼与Vadimezan的合成高密度脂蛋白用于转移性三阴性乳腺癌联合化疗免疫治疗
2022-09-10 14:49
三阴性乳腺癌(TNBC)是指雌激素受体、孕激素受体和人表皮生长因子受体均为阴性的乳腺癌,其远端转移较为常见,5年生存率仅29%,是临床上预后最差的乳腺癌之一。目前化疗或化疗联合免疫检查点阻断(ICB)疗法是转移性TNBC的一线疗法。其中,化疗的免疫激活效应是其长效抑制肿瘤复发的重要机制,但转移性TNBC中抗原展示不足和细胞毒性T细胞(CTL)浸润低,导致化疗和ICB疗法效果有限。此外,常规化疗也会产生系统性免疫抑制,同时为了降低化疗副作用,通常还需在治疗前使用免疫抑制药物。因此,探索新的免疫激活疗法及其ICB联用策略有望改善转移性TNBC患者预后。
《药学学报》英文刊(Acta Pharmaceutica Sinica B)2022年第二期上发表了一篇题为Lenvatinib- and vadimezan-loaded synthetic high-density lipoprotein for combinational immunochemotherapy of metastatic triple-negative breast cancer的文章,介绍了烟台新药创制山东省实验室李亚平研究员和上海药物所张鹏程研究员团队的最新研究成果。该研究用共载乐伐替尼与Vadimezan的合成高密度脂蛋白用于转移性三阴性乳腺癌联合化疗免疫治疗,有效“加热”了转移性三阴性乳腺癌肿瘤,提高免疫治疗效果。

酪氨酸激酶抑制剂(TKI)通过调控肿瘤细胞过度激活的通路来诱导肿瘤细胞死亡,相比传统化疗具有更好的选择性和安全性。利用TKI来替代传统化疗,提高抗肿瘤免疫,是目前转移性TNBC治疗的重要方向。但TKI由于无法诱导肿瘤细胞急性损伤,在激发肿瘤原位炎症反应上效应不足,从而无法有效激发抗肿瘤免疫。本文探索了TKI乐伐替尼联合STING (Stimulator of Interferon Genes)激动剂Vadimezan的转移性TNBC治疗策略,并采用合成高密度脂蛋白(sHDL)实现肿瘤局部的药物递送和炎症诱导。结果显示:sHDL有效将药物递送到高表达清道夫受体(SR-B1)的TNBC细胞(4T1)。其中,乐伐替尼可诱导肿瘤细胞免疫原性死亡或抑制干扰素诱导的程序性死亡受体配体1(PDL1)上调,而Vadimezan则能诱导肿瘤局部炎症反应,激活树突状细胞(DC)成熟和肿瘤特异性CTL招募,与ICB疗法联用,有效抑制了TNBC原位瘤生长和肺转移。本研究探索了TKI与STING激动剂联合用于转移性TNBC化疗免疫治疗策略,揭示了其协同增强抗肿瘤免疫提高转移性TNBC治疗效果的机制,为转移性TNBC治疗提供了借鉴。
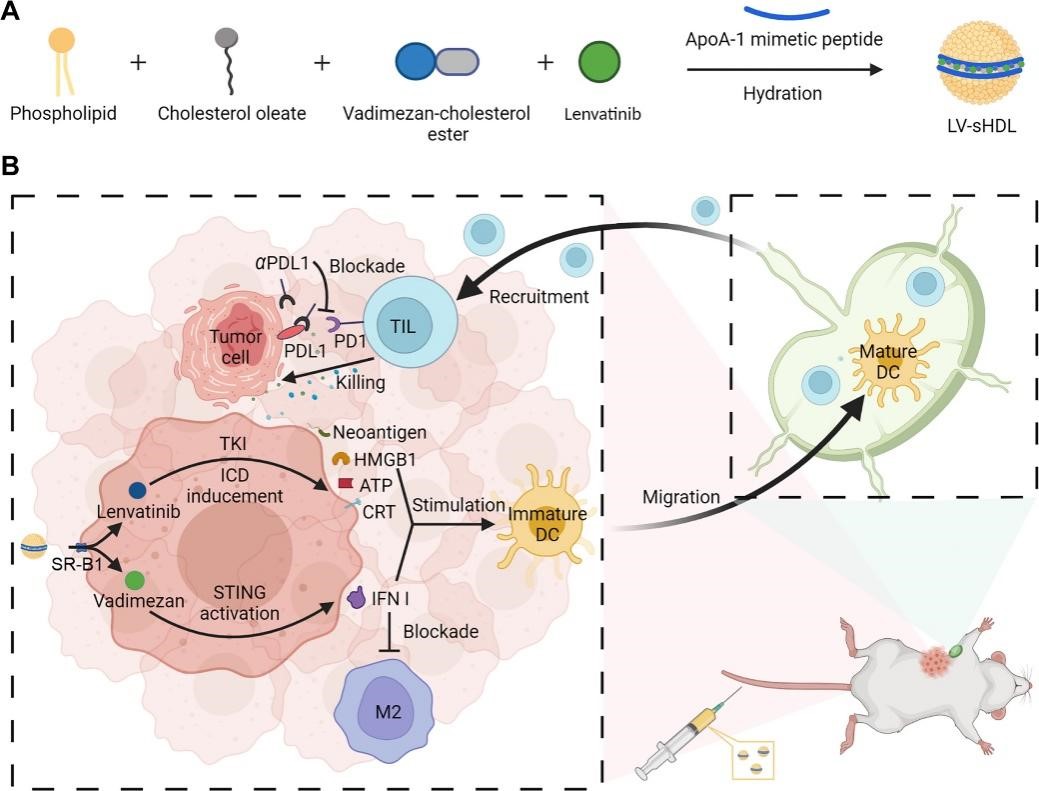
图1 LV-sHDL增强免疫应答、调节免疫抑制微环境,提高抗肿瘤效果
烟台新药创制山东省实验室李亚平研究员和上海药物所张鹏程研究员为本文的共同通讯作者,博士生郑超为本文第一作者。该研究得到了中国国家自然科学基金会、山东省自然基金会的资助。
全文链接:https://www.sciencedirect.com/science/article/pii/S2211383522000776
(供稿部门:李亚平课题组;供稿人:张鹏程)
APSB | 共载乐伐替尼与Vadimezan的合成高密度脂蛋白用于转移性三阴性乳腺癌联合化疗免疫治疗
2022-09-10 14:49
三阴性乳腺癌(TNBC)是指雌激素受体、孕激素受体和人表皮生长因子受体均为阴性的乳腺癌,其远端转移较为常见,5年生存率仅29%,是临床上预后最差的乳腺癌之一。目前化疗或化疗联合免疫检查点阻断(ICB)疗法是转移性TNBC的一线疗法。其中,化疗的免疫激活效应是其长效抑制肿瘤复发的重要机制,但转移性TNBC中抗原展示不足和细胞毒性T细胞(CTL)浸润低,导致化疗和ICB疗法效果有限。此外,常规化疗也会产生系统性免疫抑制,同时为了降低化疗副作用,通常还需在治疗前使用免疫抑制药物。因此,探索新的免疫激活疗法及其ICB联用策略有望改善转移性TNBC患者预后。
《药学学报》英文刊(Acta Pharmaceutica Sinica B)2022年第二期上发表了一篇题为Lenvatinib- and vadimezan-loaded synthetic high-density lipoprotein for combinational immunochemotherapy of metastatic triple-negative breast cancer的文章,介绍了烟台新药创制山东省实验室李亚平研究员和上海药物所张鹏程研究员团队的最新研究成果。该研究用共载乐伐替尼与Vadimezan的合成高密度脂蛋白用于转移性三阴性乳腺癌联合化疗免疫治疗,有效“加热”了转移性三阴性乳腺癌肿瘤,提高免疫治疗效果。

酪氨酸激酶抑制剂(TKI)通过调控肿瘤细胞过度激活的通路来诱导肿瘤细胞死亡,相比传统化疗具有更好的选择性和安全性。利用TKI来替代传统化疗,提高抗肿瘤免疫,是目前转移性TNBC治疗的重要方向。但TKI由于无法诱导肿瘤细胞急性损伤,在激发肿瘤原位炎症反应上效应不足,从而无法有效激发抗肿瘤免疫。本文探索了TKI乐伐替尼联合STING (Stimulator of Interferon Genes)激动剂Vadimezan的转移性TNBC治疗策略,并采用合成高密度脂蛋白(sHDL)实现肿瘤局部的药物递送和炎症诱导。结果显示:sHDL有效将药物递送到高表达清道夫受体(SR-B1)的TNBC细胞(4T1)。其中,乐伐替尼可诱导肿瘤细胞免疫原性死亡或抑制干扰素诱导的程序性死亡受体配体1(PDL1)上调,而Vadimezan则能诱导肿瘤局部炎症反应,激活树突状细胞(DC)成熟和肿瘤特异性CTL招募,与ICB疗法联用,有效抑制了TNBC原位瘤生长和肺转移。本研究探索了TKI与STING激动剂联合用于转移性TNBC化疗免疫治疗策略,揭示了其协同增强抗肿瘤免疫提高转移性TNBC治疗效果的机制,为转移性TNBC治疗提供了借鉴。

图1 LV-sHDL增强免疫应答、调节免疫抑制微环境,提高抗肿瘤效果
烟台新药创制山东省实验室李亚平研究员和上海药物所张鹏程研究员为本文的共同通讯作者,博士生郑超为本文第一作者。该研究得到了中国国家自然科学基金会、山东省自然基金会的资助。
全文链接:https://www.sciencedirect.com/science/article/pii/S2211383522000776
(供稿部门:李亚平课题组;供稿人:张鹏程)