


新闻资讯
烟台新药创制山东省实验室/海洋药物研究中心郭跃伟团队和徐宝福团队合作取得重要进展:首次完成国内海洋珊瑚天然产物的生物合成研究
2025-02-27 10:29
2025年2月26日,烟台新药创制山东省实验室、中科环渤海(烟台)药物高等海洋药物研究中心的郭跃伟团队和徐宝福团队,联合中国科学院上海免疫与感染研究所的王程远团队以及中山大学的巫瑞波团队,在国际顶级期刊《Science Advances》上发表了题为“Mining coral-derived terpene synthases and mechanistic studies of the coral biflorane synthase”的研究论文。该研究首次完成了国内海洋珊瑚的生物合成研究,标志着我国在该领域取得重大突破,填补了国内空白,为海洋珊瑚萜类化合物的生物合成研究开辟了新的方向。
萜类化合物是自然界中最为丰富的天然产物之一,其结构多样性主要源于植物和微生物等的特殊代谢过程。这类化合物在医药领域具有重要意义,许多重要的临床药物如紫杉醇和青蒿素都源自萜类化合物。在海洋生态系统中,无脊椎动物珊瑚是萜类化合物的主要来源之一。迄今为止,科学家已从珊瑚中分离出超过4000种倍半萜和二萜类化合物,其中许多具有新颖的碳骨架和显著的生物活性。以伪蕨素类化合物pseudopterosin A为例,它不仅表现出显著的抗炎和镇痛活性,还在化妆品领域创造了数十亿欧元的市场价值。然而,pseudopterosin A的主要来源依赖于从柳珊瑚中提取分离,这种传统方法无法满足大规模的市场需求。尽管已有一些化学全合成的研究报道,但这些方法在效率和产量上仍存在局限,凸显了珊瑚天然产物研究面临的药源供应难题。
随着合成生物学的快速发展,通过生物合成途径解析和异源表达实现目标产物的持续高效生产,已成为解决天然产物药源问题的重要手段。目前,国外科学家已开始布局珊瑚萜类化合物的生物合成研究,并取得了一些突破性进展。然而,国内在这一领域的研究仍处于空白状态。为了填补这一空白,研究团队对公开的柳珊瑚Paramuricea clavata基因组进行了深入挖掘,成功发现了一种新型biflorane合酶,并对其催化机制进行了详细研究。通过对该酶的工程改造,研究团队为理解海洋萜类合酶的催化原理及后续的生物合成研究奠定了重要基础。这一突破不仅推动了国内珊瑚生物合成研究的发展,也为解决珊瑚天然产物的药源问题提供了新的思路。
研究团队通过系统性的柳珊瑚Paramuricea clavata基因组分析(图1),发现了5个倍半萜合酶和1个二萜合酶PcTS1,其中PcTS1可以催化伪蕨素化合物前体化合物elisabethatriene的生物合成。Elisabethatriene具有6,6-双环的biflorane碳骨架,然而海洋biflorane合酶的催化机制尚未被解析,因此研究人员对二萜合酶PcTS1的催化机制进行了系统的研究。
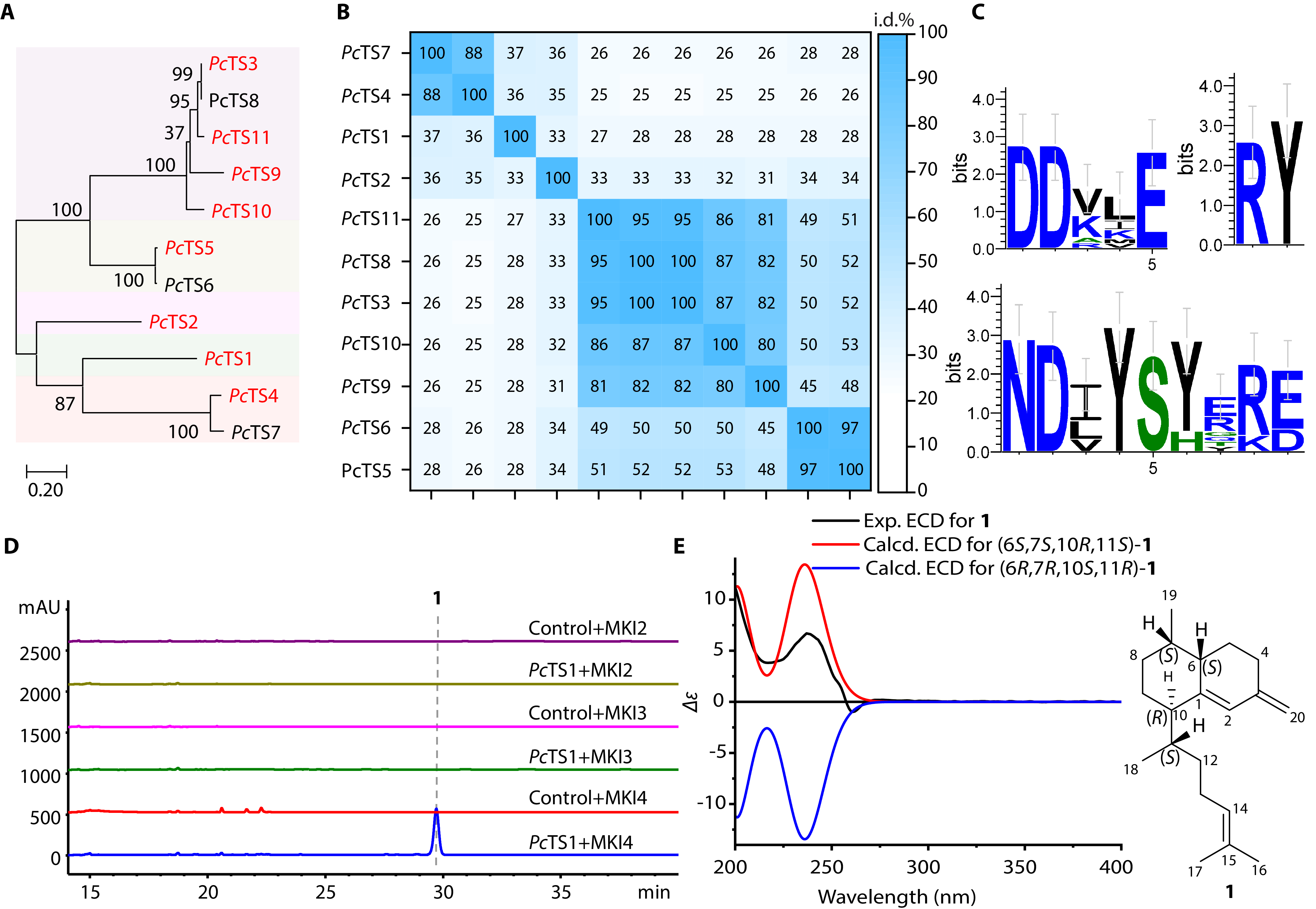
图1 柳珊瑚P. clavata中萜类合酶的挖掘和活性表征
研究人员推测了两种可能的环化机制(图2),elisabethatriene的环化首先要经过2号位双键的翻转,一般会经过GLPP和2Z-GGPP,生成准备环化的碳阳离子中间体,在途径I中,先1,10-环化,之后发生一次1,3-氢迁移或两次1,2-氢迁移,1,6-环化,随后发生一次1,3-氢迁移或两次1,2-氢迁移,形成碳阳离子,脱质子化形成最终产物。在途径II中,该过程先1,6-环化,后1,10-环化。

图2 PcTS1两种可能的环化机制
为了验证推测的PcTS1的环化路径,研究人员合成了一系列底物,不同底物与PcTS1蛋白体外孵育结果,成功的确定了PcTS1的环化机制为先1,10-环化,之后发生一次1,3-氢迁移,1,6-环化,随后发生两次1,2-氢迁移,形成碳阳离子,脱质子化形成最终产物(图3)。
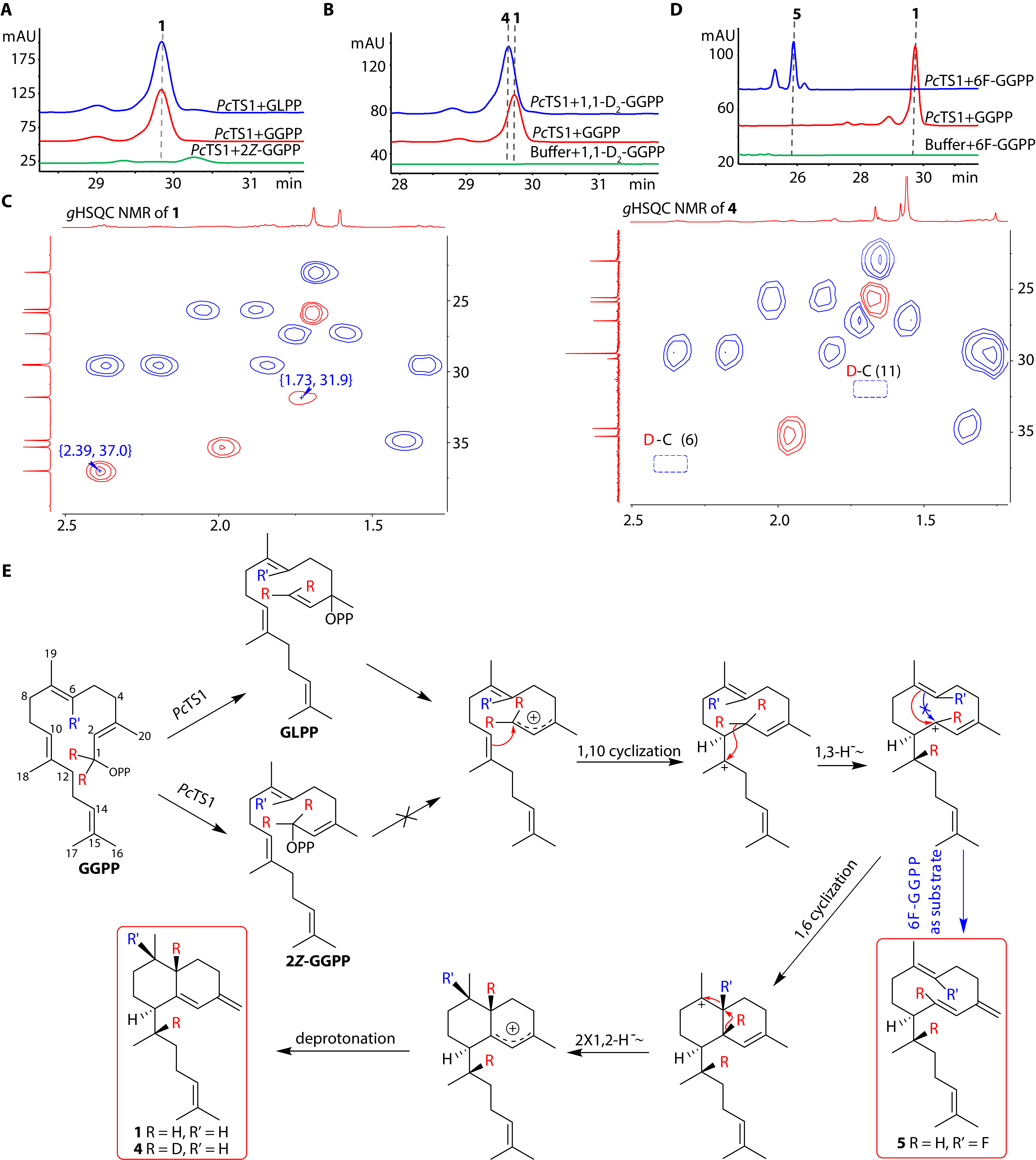
图3 同位素标记实验解析PcTS1的环化机制
为了深入理解PcTS1的催化结构基础,研究人员对PcTS1进行了晶体结构解析,经过蛋白纯化和晶体培养,最终成功获得了PcTS1的蛋白晶体(图4),并解析出了其单晶结构(分辨率为3.5 Å,PDB ID: 8ZWZ)。通过分析PcTS1的蛋白晶体结构,研究人员发现珊瑚来源的萜类合酶与微生物来源的萜类合酶在结构上具有较高的相似性。这是目前第二例海洋来源蛋白晶体的报道,有助于研究人员对海洋来源萜类合酶催化结构基础的理解,为后续研究中的工程改造奠定基础。

图4 PcTS1的蛋白结构
为了深化对海洋biflorane合酶催化过程的认识,研究人员在晶体结构解析的基础上,进一步采用了量子力学/分子力学(quantum mechanics/molecular mechanics,QM/MM)模拟计算。通过对PcTS1催化过程中蛋白与底物相互作用的细致分析,研究确认了之前通过实验标记过程解析的PcTS1环化机制的准确性。此外,QM/MM计算还揭示了在1,6-环化后的两次1,2-氢迁移过程中,发生了2,6-环化和开环的中间步骤,这展现了QM/MM计算在解析催化机制细节方面的重要作用。进一步地,QM/MM计算还揭示了底物最终的脱氢过程是通过焦磷酸基团上的羰基拔氢作用实现的(图5),这一发现为理解PcTS1的催化机制提供了更为精确的视角,为未来的酶工程研究提供了重要的理论依据。

图5 PcTS1的QM/MM计算
在解析PcTS1催化机制的基础上,研究人员对该酶进行了工程改造。通过对焦磷酸结合位点和疏水氨基酸口袋中的关键氨基酸进行丙氨酸突变,发现突变体的活性显著降低(图6),这表明这些氨基酸在PcTS1催化过程中扮演着至关重要的角色。研究人员还将PcTS1催化的关键氨基酸位点向结构有一定化学进化关系的西松烷合酶和eunicellane合酶进行了突变,生成了4种具有不同骨架的化合物,这些化合物分别对应于PcTS1催化机制中不同的阶段。这一发现不仅进一步验证了对PcTS1催化机制的解析,而且还展示了通过特定氨基酸的突变,可以有效地改变关键氨基酸与底物的相互作用,从而调控催化路径,生成新的产物。这一成果为酶的定向进化和小分子药物的设计提供了新的思路。

图6 PcTS1的突变研究
本研究对柳珊瑚P. clavata中的萜类合酶的全面挖掘与发现,再次表明珊瑚本身可以生产活性萜类化合物,为解决珊瑚活性化合物的药源问题提出了新的解决方案,即通过生物合成研究实现珊瑚化合物的异源高效生产。Biflorane化合物多具有显著的活性,尤其是本研究发现的biflorane合酶PcTS1催化产物是伪蕨素类化合物的生物合成前体,继续进行PcTS1催化产物的氧化和糖基化等修饰的研究,有望实现伪蕨素类化合物的异源高效生产,提供更多的化妆品原料,创造巨大经济价值。对biflorane合酶催化机制的全面解析,有助于加深科研人员对海洋来源萜类合酶的理解,为后续的研究奠定坚实的基础,本研究在催化机制解析指导下的工程改造成功的生成了多个新产物,尤其包含4类不同骨架的二萜,扩展了萜类骨架的多样性,为活性先导化合物的发现提供了更多的素材。研究团队表示,未来将继续深入研究海洋珊瑚萜类化合物的生物合成机制,并致力于利用合成生物学技术实现目标化合物的异源高效生产。目前,研究团队成功搭建起针对biflorane 骨架的合成生物学体系,其产量能够达到百毫克每升,这一成果为相关化合物的可持续供应创造了可能。本研究是国内首例海洋珊瑚的生物合成研究报道,加快了国内海洋珊瑚生物合成研究的进程,为解决多年以来的海洋珊瑚活性化合物的来源问题提供了新的解决方案,即通过生物合成研究实现海洋珊瑚活性化合物的异源高效生产。
徐宝福研究员团队及其合作者将以此为基础,未来计划推进海洋珊瑚、海绵天然药物研究领域的更新换代,实现“合成生物学研究驱动下的海洋动物药物研发”,解决海洋动物药物研发面临的关键化合物来源供应紧缺的瓶颈问题,致力于在不久的将来实现多个海洋动物药物的成功开发。
该研究论文的共同第一作者包括烟台新药创制山东省实验室的陈宝博士(徐宝福团队)、中国科学院上海感染与免疫研究所的冒婧敬博士(王程远团队)以及中山大学的博士生徐康为(巫瑞波团队)。此外,徐宝福团队的刘丽君和南京中医药大学医学院•整合医学学院的林炜教授也为这项工作做出了重要贡献。该论文的共同通讯作者为烟台新药创制山东省实验室与上海大学医学院郭跃伟研究员、中山大学的巫瑞波教授、中国科学院上海免疫与感染研究所的王程远研究员、烟台新药创制山东省实验室与中国科学院上海药物研究所徐宝福研究员。
此项研究得到了国家重点研发计划、国家自然科学基金项目、泰山学者项目、山东省实验室专项基金、山东省重点研发计划、山东省自然科学基金项目、上海白玉兰人才计划浦江项目以及中国科学院“择优引才”项目等多个项目和单位的大力资助。此外,徐宝福研究员特别感谢郭跃伟研究员、林厚文教授和鞠建华教授给予的大力支持与帮助。
研究团队介绍:

徐宝福,烟台新药创制山东省实验室课题组长,长期从事萜类化合物生物合成机制解析与合成生物学相关的研究工作,迄今在国际学术期刊共发表22篇论文,包括通讯作者(含共同)论文6篇,第一作者(含共同)7篇,其中通讯或一作论文包括:Nat. Commun., Sci. Adv., Angew. Chem. Int. Ed. (2篇), ACS Catal.,Org. Lett.等知名学术期刊发表的科研论文。徐宝福团队聚焦开展基因组导向的萜类化合物发现与生物合成研究,涉及生物材料包括海洋动物、植物及其共生微生物等。该团队依托基因组学、转录组学技术、生物催化及发酵技术,致力于完成发现-解析-生产的核心科研使命:即活性萜类天然产物的发现、生物合成的解析、以及最后利用合成生物学理念实现化合物的绿色高效可持续生产,以驱动原创萜类新药的开发。
徐宝福实验室链接:http://chemxulab.com
论文链接:https://www.science.org/doi/10.1126/sciadv.adv0805
烟台新药创制山东省实验室/海洋药物研究中心郭跃伟团队和徐宝福团队合作取得重要进展:首次完成国内海洋珊瑚天然产物的生物合成研究
2025-02-27 10:29
2025年2月26日,烟台新药创制山东省实验室、中科环渤海(烟台)药物高等海洋药物研究中心的郭跃伟团队和徐宝福团队,联合中国科学院上海免疫与感染研究所的王程远团队以及中山大学的巫瑞波团队,在国际顶级期刊《Science Advances》上发表了题为“Mining coral-derived terpene synthases and mechanistic studies of the coral biflorane synthase”的研究论文。该研究首次完成了国内海洋珊瑚的生物合成研究,标志着我国在该领域取得重大突破,填补了国内空白,为海洋珊瑚萜类化合物的生物合成研究开辟了新的方向。

萜类化合物是自然界中最为丰富的天然产物之一,其结构多样性主要源于植物和微生物等的特殊代谢过程。这类化合物在医药领域具有重要意义,许多重要的临床药物如紫杉醇和青蒿素都源自萜类化合物。在海洋生态系统中,无脊椎动物珊瑚是萜类化合物的主要来源之一。迄今为止,科学家已从珊瑚中分离出超过4000种倍半萜和二萜类化合物,其中许多具有新颖的碳骨架和显著的生物活性。以伪蕨素类化合物pseudopterosin A为例,它不仅表现出显著的抗炎和镇痛活性,还在化妆品领域创造了数十亿欧元的市场价值。然而,pseudopterosin A的主要来源依赖于从柳珊瑚中提取分离,这种传统方法无法满足大规模的市场需求。尽管已有一些化学全合成的研究报道,但这些方法在效率和产量上仍存在局限,凸显了珊瑚天然产物研究面临的药源供应难题。
随着合成生物学的快速发展,通过生物合成途径解析和异源表达实现目标产物的持续高效生产,已成为解决天然产物药源问题的重要手段。目前,国外科学家已开始布局珊瑚萜类化合物的生物合成研究,并取得了一些突破性进展。然而,国内在这一领域的研究仍处于空白状态。为了填补这一空白,研究团队对公开的柳珊瑚Paramuricea clavata基因组进行了深入挖掘,成功发现了一种新型biflorane合酶,并对其催化机制进行了详细研究。通过对该酶的工程改造,研究团队为理解海洋萜类合酶的催化原理及后续的生物合成研究奠定了重要基础。这一突破不仅推动了国内珊瑚生物合成研究的发展,也为解决珊瑚天然产物的药源问题提供了新的思路。
研究团队通过系统性的柳珊瑚Paramuricea clavata基因组分析(图1),发现了5个倍半萜合酶和1个二萜合酶PcTS1,其中PcTS1可以催化伪蕨素化合物前体化合物elisabethatriene的生物合成。Elisabethatriene具有6,6-双环的biflorane碳骨架,然而海洋biflorane合酶的催化机制尚未被解析,因此研究人员对二萜合酶PcTS1的催化机制进行了系统的研究。

图1 柳珊瑚P. clavata中萜类合酶的挖掘和活性表征
研究人员推测了两种可能的环化机制(图2),elisabethatriene的环化首先要经过2号位双键的翻转,一般会经过GLPP和2Z-GGPP,生成准备环化的碳阳离子中间体,在途径I中,先1,10-环化,之后发生一次1,3-氢迁移或两次1,2-氢迁移,1,6-环化,随后发生一次1,3-氢迁移或两次1,2-氢迁移,形成碳阳离子,脱质子化形成最终产物。在途径II中,该过程先1,6-环化,后1,10-环化。

图2 PcTS1两种可能的环化机制
为了验证推测的PcTS1的环化路径,研究人员合成了一系列底物,不同底物与PcTS1蛋白体外孵育结果,成功的确定了PcTS1的环化机制为先1,10-环化,之后发生一次1,3-氢迁移,1,6-环化,随后发生两次1,2-氢迁移,形成碳阳离子,脱质子化形成最终产物(图3)。

图3 同位素标记实验解析PcTS1的环化机制
为了深入理解PcTS1的催化结构基础,研究人员对PcTS1进行了晶体结构解析,经过蛋白纯化和晶体培养,最终成功获得了PcTS1的蛋白晶体(图4),并解析出了其单晶结构(分辨率为3.5 Å,PDB ID: 8ZWZ)。通过分析PcTS1的蛋白晶体结构,研究人员发现珊瑚来源的萜类合酶与微生物来源的萜类合酶在结构上具有较高的相似性。这是目前第二例海洋来源蛋白晶体的报道,有助于研究人员对海洋来源萜类合酶催化结构基础的理解,为后续研究中的工程改造奠定基础。

图4 PcTS1的蛋白结构
为了深化对海洋biflorane合酶催化过程的认识,研究人员在晶体结构解析的基础上,进一步采用了量子力学/分子力学(quantum mechanics/molecular mechanics,QM/MM)模拟计算。通过对PcTS1催化过程中蛋白与底物相互作用的细致分析,研究确认了之前通过实验标记过程解析的PcTS1环化机制的准确性。此外,QM/MM计算还揭示了在1,6-环化后的两次1,2-氢迁移过程中,发生了2,6-环化和开环的中间步骤,这展现了QM/MM计算在解析催化机制细节方面的重要作用。进一步地,QM/MM计算还揭示了底物最终的脱氢过程是通过焦磷酸基团上的羰基拔氢作用实现的(图5),这一发现为理解PcTS1的催化机制提供了更为精确的视角,为未来的酶工程研究提供了重要的理论依据。

图5 PcTS1的QM/MM计算
在解析PcTS1催化机制的基础上,研究人员对该酶进行了工程改造。通过对焦磷酸结合位点和疏水氨基酸口袋中的关键氨基酸进行丙氨酸突变,发现突变体的活性显著降低(图6),这表明这些氨基酸在PcTS1催化过程中扮演着至关重要的角色。研究人员还将PcTS1催化的关键氨基酸位点向结构有一定化学进化关系的西松烷合酶和eunicellane合酶进行了突变,生成了4种具有不同骨架的化合物,这些化合物分别对应于PcTS1催化机制中不同的阶段。这一发现不仅进一步验证了对PcTS1催化机制的解析,而且还展示了通过特定氨基酸的突变,可以有效地改变关键氨基酸与底物的相互作用,从而调控催化路径,生成新的产物。这一成果为酶的定向进化和小分子药物的设计提供了新的思路。

图6 PcTS1的突变研究
本研究对柳珊瑚P. clavata中的萜类合酶的全面挖掘与发现,再次表明珊瑚本身可以生产活性萜类化合物,为解决珊瑚活性化合物的药源问题提出了新的解决方案,即通过生物合成研究实现珊瑚化合物的异源高效生产。Biflorane化合物多具有显著的活性,尤其是本研究发现的biflorane合酶PcTS1催化产物是伪蕨素类化合物的生物合成前体,继续进行PcTS1催化产物的氧化和糖基化等修饰的研究,有望实现伪蕨素类化合物的异源高效生产,提供更多的化妆品原料,创造巨大经济价值。对biflorane合酶催化机制的全面解析,有助于加深科研人员对海洋来源萜类合酶的理解,为后续的研究奠定坚实的基础,本研究在催化机制解析指导下的工程改造成功的生成了多个新产物,尤其包含4类不同骨架的二萜,扩展了萜类骨架的多样性,为活性先导化合物的发现提供了更多的素材。研究团队表示,未来将继续深入研究海洋珊瑚萜类化合物的生物合成机制,并致力于利用合成生物学技术实现目标化合物的异源高效生产。目前,研究团队成功搭建起针对biflorane 骨架的合成生物学体系,其产量能够达到百毫克每升,这一成果为相关化合物的可持续供应创造了可能。本研究是国内首例海洋珊瑚的生物合成研究报道,加快了国内海洋珊瑚生物合成研究的进程,为解决多年以来的海洋珊瑚活性化合物的来源问题提供了新的解决方案,即通过生物合成研究实现海洋珊瑚活性化合物的异源高效生产。
徐宝福研究员团队及其合作者将以此为基础,未来计划推进海洋珊瑚、海绵天然药物研究领域的更新换代,实现“合成生物学研究驱动下的海洋动物药物研发”,解决海洋动物药物研发面临的关键化合物来源供应紧缺的瓶颈问题,致力于在不久的将来实现多个海洋动物药物的成功开发。
该研究论文的共同第一作者包括烟台新药创制山东省实验室的陈宝博士(徐宝福团队)、中国科学院上海感染与免疫研究所的冒婧敬博士(王程远团队)以及中山大学的博士生徐康为(巫瑞波团队)。此外,徐宝福团队的刘丽君和南京中医药大学医学院•整合医学学院的林炜教授也为这项工作做出了重要贡献。该论文的共同通讯作者为烟台新药创制山东省实验室与上海大学医学院郭跃伟研究员、中山大学的巫瑞波教授、中国科学院上海免疫与感染研究所的王程远研究员、烟台新药创制山东省实验室与中国科学院上海药物研究所徐宝福研究员。
此项研究得到了国家重点研发计划、国家自然科学基金项目、泰山学者项目、山东省实验室专项基金、山东省重点研发计划、山东省自然科学基金项目、上海白玉兰人才计划浦江项目以及中国科学院“择优引才”项目等多个项目和单位的大力资助。此外,徐宝福研究员特别感谢郭跃伟研究员、林厚文教授和鞠建华教授给予的大力支持与帮助。
研究团队介绍:

徐宝福,烟台新药创制山东省实验室课题组长,长期从事萜类化合物生物合成机制解析与合成生物学相关的研究工作,迄今在国际学术期刊共发表22篇论文,包括通讯作者(含共同)论文6篇,第一作者(含共同)7篇,其中通讯或一作论文包括:Nat. Commun., Sci. Adv., Angew. Chem. Int. Ed. (2篇), ACS Catal.,Org. Lett.等知名学术期刊发表的科研论文。徐宝福团队聚焦开展基因组导向的萜类化合物发现与生物合成研究,涉及生物材料包括海洋动物、植物及其共生微生物等。该团队依托基因组学、转录组学技术、生物催化及发酵技术,致力于完成发现-解析-生产的核心科研使命:即活性萜类天然产物的发现、生物合成的解析、以及最后利用合成生物学理念实现化合物的绿色高效可持续生产,以驱动原创萜类新药的开发。
徐宝福实验室链接:http://chemxulab.com
论文链接:https://www.science.org/doi/10.1126/sciadv.adv0805