


新闻资讯
Chin. Chem. Lett. | 长波长蛋白复合荧光探针助力非酒精性脂肪肝病的早期诊断与药效学示踪评价
2024-02-23 14:01
非酒精性脂肪肝疾病(NAFLD)是全球最常见的慢性肝病,影响着全球约25-30%的成年人。该疾病不仅会导致肝硬化、肝癌等肝脏并发症,还与2型糖尿病、动脉粥样硬化等慢性疾病密切相关,因此对其早期诊断至关重要。然而,传统检测技术如肝活检、影像学检查(超声、CT、MRI等)和血清学检测因存在侵入性强、价格昂贵、敏感性低等缺陷,难以满足目前对NAFLD早期诊断与分子机制研究的需求,因此开发新型检测手段迫在眉睫。
荧光生物成像检测技术因具有灵敏度高、操作简单、检测下限低、响应速度快、时空分辨率优异以及无损体内原位成像等特性,已被应用于疾病生物标志物的检测,为疾病早期诊断提供了较为可靠的依据。近日,中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室李佳课题组、韩海浩课题组联合华东理工大学化学与分子工程学院,费林加诺贝尔奖科学家联合研究中心贺晓鹏课题组、临港实验室臧奕课题组与潍坊医学院董磊课题组成功设计开发了长波长蛋白复合荧光探针LD-1@BSA,助力NAFLD的实时监测与药效学评价示踪。相关成果以“Protein-encapsulated long-wavelength fluorescent probe hybrid for imaging lipid droplets in living cells and mice with non-alcoholic fatty liver”为题于2024年2月6日在线发表于化学权威杂志Chinese Chemical Letters(中科院一区,TOP期刊,IF 9.1)。

NAFLD的主要病理特征是肝脏中富含甘油三酯的脂滴(LDs)过度累积。原位检测肝脏中LDs的水平可直接地表明脂质堆积,从而有助于NAFLD早期诊断。因此,研究团队首先设计并合成了新型脂滴特异性长波长荧光探针LD-1(图1),其在溶液中展现出来了对极性与粘度的灵敏响应。随后,为了进一步提高探针LD-1的生物相容性和稳定性,基于团队前期研究基础(J. Am. Chem. Soc. 2020, 142, 18005; Chem. Sci. 2020, 11, 1107; Chem. Commun. 2022, 58, 5029.),将其与白蛋白自组装构建形成复合探针LD-1@BSA,利用分子对接解析了LD-1和白蛋白之间的结合模式,通过蛋白质-配体相互作用谱(PLIP)分析发现其主要通过与Glu186、Thr190、Trp213、Arg217、Leu218、Lys221、Leu237和Ala290等氨基酸的疏水相互作用、与Arg198和His241的氢键作用以及与Arg194之间的阳离子-π相互作用而结合在白蛋白的IIA结构域。在细胞水平实验中,LD-1@BSA可以准确的对胞内脂滴进行定位指征且光稳定性优于市售脂滴荧光探针Nile Red,此外其可对脂滴的动态过程(融合和脂解)进行准确的标记与示踪。LD-1@BSA展现的良好生物安全性和生物标记性能为接下来应用于NAFLD疾病的诊断提供了有力支撑。随后,研究团队利用油酸(OA)在肝细胞系HepG2与原代肝细胞中构建NAFLD细胞模型与经典阳性药物奥贝胆酸(OCA)抑制细胞脂质累积模型,将LD-1@BSA应用于这两种细胞模型指征中,结果显示探针LD-1@BSA有效区分OA诱导的NAFLD细胞模型与阳性药物OCA缓解模型,且相较于传统抽脂检测手段具有原位示踪、操作简易、耗时短、价格低廉等优势。最后,研究团队对瘦素基因纯合突变(ob/ob)小鼠采用 HFD 饲料喂养以构建NAFLD动物模型,并将LD-1@BSA应用于NAFLD小鼠与正常组小鼠的体内成像中,结果也显示出其对NAFLD小鼠的有效原位体内成像,且离体器官成像中两组肝脏也展现出了显著荧光差异。该工作为NAFLD 疾病的早期诊断与药效学评价提供了可行性的新型化学探针工具。
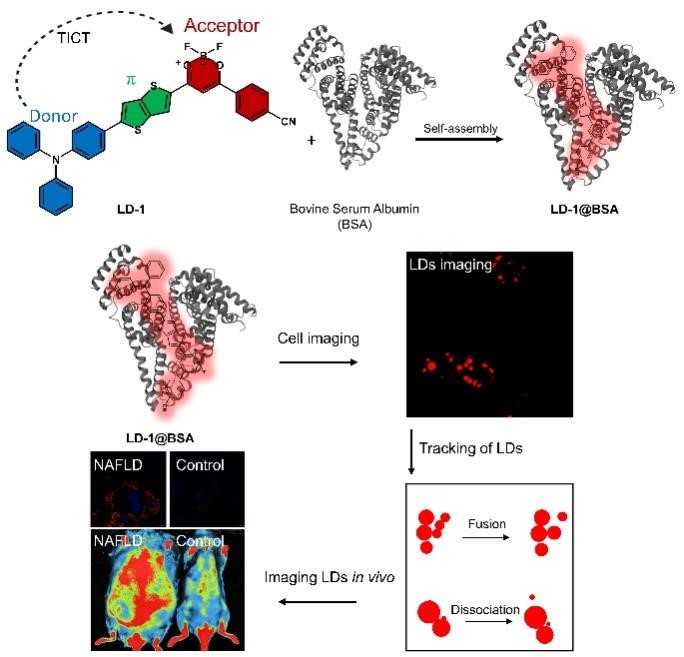
图1:LD-1@BSA的构建及其应用于NAFLD成像与示踪的示意图
李佳课题组在站博士后王瀚敏博士为本文第一作者,中科环渤海(烟台)药物高等研究院李佳研究员、韩海浩副研究员,华东理工大学贺晓鹏教授,临港实验室臧奕研究员与潍坊医学院董磊博士为本文共同通讯作者。上海药物所刘佳研究员、研究生李彦辰、唐铭烨、临港实验室蔡佳浩、烟台新药创制山东省实验室孙璐璐对本论文的完成提供了大力支持和帮助。本工作得到了国家自然科学基金重点项目、重大研究计划集成项目、面上项目、青年基金项目,泰山学者项目,中国化学会青年人才托举工程项目,山东省实验室项目以及烟台市科技创新发展计划基础研究项目等基金项目的资助。
全文链接
https://doi.org/10.1016/j.cclet.2024.109603
(供稿部门:李佳课题组、韩海浩课题组;供稿人:李佳课题组、韩海浩课题组)
Chin. Chem. Lett. | 长波长蛋白复合荧光探针助力非酒精性脂肪肝病的早期诊断与药效学示踪评价
2024-02-23 14:01
非酒精性脂肪肝疾病(NAFLD)是全球最常见的慢性肝病,影响着全球约25-30%的成年人。该疾病不仅会导致肝硬化、肝癌等肝脏并发症,还与2型糖尿病、动脉粥样硬化等慢性疾病密切相关,因此对其早期诊断至关重要。然而,传统检测技术如肝活检、影像学检查(超声、CT、MRI等)和血清学检测因存在侵入性强、价格昂贵、敏感性低等缺陷,难以满足目前对NAFLD早期诊断与分子机制研究的需求,因此开发新型检测手段迫在眉睫。
荧光生物成像检测技术因具有灵敏度高、操作简单、检测下限低、响应速度快、时空分辨率优异以及无损体内原位成像等特性,已被应用于疾病生物标志物的检测,为疾病早期诊断提供了较为可靠的依据。近日,中科环渤海(烟台)药物高等研究院/烟台新药创制山东省实验室李佳课题组、韩海浩课题组联合华东理工大学化学与分子工程学院,费林加诺贝尔奖科学家联合研究中心贺晓鹏课题组、临港实验室臧奕课题组与潍坊医学院董磊课题组成功设计开发了长波长蛋白复合荧光探针LD-1@BSA,助力NAFLD的实时监测与药效学评价示踪。相关成果以“Protein-encapsulated long-wavelength fluorescent probe hybrid for imaging lipid droplets in living cells and mice with non-alcoholic fatty liver”为题于2024年2月6日在线发表于化学权威杂志Chinese Chemical Letters(中科院一区,TOP期刊,IF 9.1)。

NAFLD的主要病理特征是肝脏中富含甘油三酯的脂滴(LDs)过度累积。原位检测肝脏中LDs的水平可直接地表明脂质堆积,从而有助于NAFLD早期诊断。因此,研究团队首先设计并合成了新型脂滴特异性长波长荧光探针LD-1(图1),其在溶液中展现出来了对极性与粘度的灵敏响应。随后,为了进一步提高探针LD-1的生物相容性和稳定性,基于团队前期研究基础(J. Am. Chem. Soc. 2020, 142, 18005; Chem. Sci. 2020, 11, 1107; Chem. Commun. 2022, 58, 5029.),将其与白蛋白自组装构建形成复合探针LD-1@BSA,利用分子对接解析了LD-1和白蛋白之间的结合模式,通过蛋白质-配体相互作用谱(PLIP)分析发现其主要通过与Glu186、Thr190、Trp213、Arg217、Leu218、Lys221、Leu237和Ala290等氨基酸的疏水相互作用、与Arg198和His241的氢键作用以及与Arg194之间的阳离子-π相互作用而结合在白蛋白的IIA结构域。在细胞水平实验中,LD-1@BSA可以准确的对胞内脂滴进行定位指征且光稳定性优于市售脂滴荧光探针Nile Red,此外其可对脂滴的动态过程(融合和脂解)进行准确的标记与示踪。LD-1@BSA展现的良好生物安全性和生物标记性能为接下来应用于NAFLD疾病的诊断提供了有力支撑。随后,研究团队利用油酸(OA)在肝细胞系HepG2与原代肝细胞中构建NAFLD细胞模型与经典阳性药物奥贝胆酸(OCA)抑制细胞脂质累积模型,将LD-1@BSA应用于这两种细胞模型指征中,结果显示探针LD-1@BSA有效区分OA诱导的NAFLD细胞模型与阳性药物OCA缓解模型,且相较于传统抽脂检测手段具有原位示踪、操作简易、耗时短、价格低廉等优势。最后,研究团队对瘦素基因纯合突变(ob/ob)小鼠采用 HFD 饲料喂养以构建NAFLD动物模型,并将LD-1@BSA应用于NAFLD小鼠与正常组小鼠的体内成像中,结果也显示出其对NAFLD小鼠的有效原位体内成像,且离体器官成像中两组肝脏也展现出了显著荧光差异。该工作为NAFLD 疾病的早期诊断与药效学评价提供了可行性的新型化学探针工具。

图1:LD-1@BSA的构建及其应用于NAFLD成像与示踪的示意图
李佳课题组在站博士后王瀚敏博士为本文第一作者,中科环渤海(烟台)药物高等研究院李佳研究员、韩海浩副研究员,华东理工大学贺晓鹏教授,临港实验室臧奕研究员与潍坊医学院董磊博士为本文共同通讯作者。上海药物所刘佳研究员、研究生李彦辰、唐铭烨、临港实验室蔡佳浩、烟台新药创制山东省实验室孙璐璐对本论文的完成提供了大力支持和帮助。本工作得到了国家自然科学基金重点项目、重大研究计划集成项目、面上项目、青年基金项目,泰山学者项目,中国化学会青年人才托举工程项目,山东省实验室项目以及烟台市科技创新发展计划基础研究项目等基金项目的资助。
全文链接
https://doi.org/10.1016/j.cclet.2024.109603
(供稿部门:李佳课题组、韩海浩课题组;供稿人:李佳课题组、韩海浩课题组)