


新闻资讯
发育中心脏心内皮的细胞间遗传示踪
2023-07-24 18:25
心脏作为人体循环系统的重要器官,通过泵送血液发挥输送营养物质,氧气和代谢废物的作用,对维持人类生命活动至关重要。心血管疾病是一种严重威胁人类健康的常见病,为社会、家庭和患者个人带来沉重负担。内皮细胞和免疫细胞是心脏的重要组成部分,在心脏早期发育及成体损伤修复中发挥重要作用,因此阐明心脏内皮细胞亚群分布以及心脏免疫细胞发育起源对了解心脏早期发育具有指导意义。
烟台新药创制山东省实验室李燕课题组参与了中国科学院分子细胞科学卓越创新中心周斌课题组的研究。在本项研究中,研究人员基于synNotch技术构建了synNotch配体工具小鼠与synNotch受体工具小鼠,利用细胞邻近标记技术(gTCCC技术)实现了对心脏内皮细胞亚群的谱系示踪。研究发现心脏内皮主要分为两群,一群属于心肌小梁层的心内膜,另一群为心肌致密层的血管内皮。通过对这两群内皮细胞亚群的发育谱系的探究,进一步发现心脏内皮细胞在发育过程不表现出造血潜能,而是形成冠状血管内皮细胞。研究成果“Intercellular Genetic Tracing of Cardiac Endothelium in the Developing Heart”于2023年6月22日发表于 Developmental Cell。

细胞与细胞通讯能够进行信号传递,功能调节等,是多细胞生物中基本的细胞行为。构建邻近细胞遗传谱系示踪新技术,阐明细胞与细胞之间的相互作用及邻近细胞谱系对解析生命活动及细胞机理具有重要意义。Notch信号通路属于经典的细胞之间交流通路,其主要依赖于邻近细胞之间的Notch配体与Notch受体结合,引起受体胞内段被γ-secretase切割,然后胞内段入核调控下游基因的表达。基于Notch通路工作原理,有研究构建了人工合成的Notch信号通路,称为Synthetic Notch(synNotch)(1)。通过在体外细胞水平表达人工合成的Notch配体与Notch受体,当配体与受体结合,就会诱导下游人工原件的激活,从而实现了细胞与细胞的邻近标记(1)。近期,周斌团队进一步地利用synNotch首次在哺乳动物体内创建了邻近细胞遗传示踪技术(gTCCC技术)(2)。此技术原理为,将Notch配体的胞外段替换为mGFP,而将Notch受体的胞外段替换为αGFP,Notch受体的胞内段替换为tTA,Notch受体的跨膜域保持不变,再结合tetO-on与Cre-loxP系统,当受体细胞与配体细胞接触时,就可以实现对受体细胞进行遗传标记。利用基于synNoth的细胞邻近标记技术,周斌团队揭示了胚胎早期心脏内皮向肝脏的迁移,以及在肿瘤生长过程中肿瘤血管内皮细胞迁移到肿瘤外包膜的现象(2),这展现了synNotch在体内邻近细胞研究方向具有重大应用前景。
心脏早期内皮主要分为两群,这两个亚群具有空间分布特点,第一群为最早在胚胎发育第8.0天(E8.0)左右出现的心管内皮细胞,称为心内膜;第二群为E12.5左右出现的心外膜下内皮细胞及其谱系。然而受于目前遗传工具的限制,还无法实现在体内对于这两种内皮细胞亚群进行特异性标记示踪。另一方面,有研究报道工具小鼠Nfatc1-Cre标记的心内膜属于生血内皮,在E9.5左右具有短暂造血活性,并且这些心内膜来源的血细胞能进入血液循环 (3, 4),然而Nfatc1并不是心内膜特异性分子标记,引起了领域内的争议。这一科学问题的解决需要建立心内膜特异性遗传工具进行细胞命运示踪。基于以上科学问题,本研究基于synNotch构建了多种邻近细胞标记技术实现了对心脏内皮细胞亚群的谱系示踪,并进一步探究了心脏发育期内皮细胞的造血活性。
首先研究人员利用已构建的Tnnt2-mGFP工具小鼠使心肌细胞表达synNotch配体,又构建了Nfatc1+细胞特异性表达synNotch受体的工具小鼠Nfatc1-αGFP-N-tTA(Nfatc1-antiGFP nanobody-Notch transmembrane domain-tTA)。研究发现在Nfatc1-αGFP-N-tTA中,Nfatc1除了在心内膜细胞表达,还表达在两种已知的卵黄囊(YS)和主动脉-性腺-中肾区(AGM)生血内皮细胞中,说明Nfatc1并不是心内膜特异性分子标记 (5)。然而在Tnnt2-mGFP;Nfatc1-αGFP-N-tTA;tetO-Cre;R26-tdT (CM-Endo-gTCCC)小鼠中,由于Tnnt2特异性表达在心肌细胞,所以只有与Tnnt2+心肌细胞接触的Nfatc1+内皮细胞才会激活synNotch信号,从而对受体细胞进行遗传标记。研究人员收取E16.5 CM-Endo-gTCCC胚胎并验证只有心脏内侧的Nfatc1+心内膜细胞被tdT标记示踪,免疫荧光染色及流式细胞分析显示这些被标记的心内膜并不会分化为心脏驻留型免疫细胞或外周血细胞,这些心内膜细胞主要分化形成冠状血管内皮细胞。
在E12.5左右,静脉窦来源的内皮细胞开始侵入心外膜下作为心脏第二群内皮细胞来源,这群内皮细胞在侵入心脏时可能会与心外膜发生相互作用,为了验证这一点并标记心脏外侧来源的内皮细胞,研究人员构建了心外膜细胞特异性表达synNotch工具小鼠Wt1-mGFP。然后对Wt1-mGFP;Cdh5-αGFP-N-tTA;tetO-Cre;R26-tdT (Epi-EC-gTCCC)小鼠心脏进行验证,发现在心脏发育中与心外膜接触过的内皮细胞被成功标记为tdT,这些细胞主要分布在心肌层外侧的致密层,研究人员也验证了这群心肌层外侧内皮细胞也不具备造血活性。为了更全面的验证心脏内皮细胞造血潜能,研究人员构建了Tnnt2-mGFP;Cdh5-αGFP-N-tTA;tetO-Cre;R26-tdT(CM-EC-gTCCC)工具小鼠并实现了对所有心脏内皮细胞无差别标记示踪(包括内侧和外侧内皮细胞),然而依然无法检测到心脏内皮细胞的造血活性。综上,研究人员利用synNotch构建了新的细胞邻近标记技术并成功实现了对心脏不同区域内皮细胞的遗传示踪,也进一步确认心脏内皮细胞在正常发育过程中不具备造血活性,为更准确地认识心脏早期发育、细胞起源及临床心脏损伤修复提供研究基础,也为心脏邻近细胞研究提供重要技术支持。
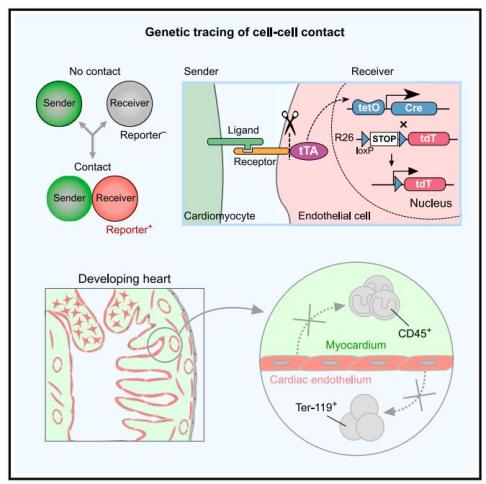
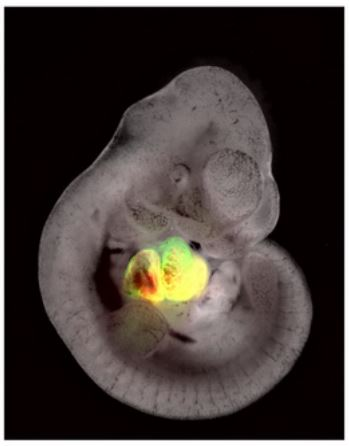
图注:利用synNotch构建细胞邻近标记技术
国科大杭州高等研究院生命与健康学院/中国科学院分子细胞科学卓越创新中心周斌研究组副研究员刘扩与中国科学院分子细胞科学卓越创新中心金恒薇博士为该论文共同第一作者,周斌研究员与刘扩副研究员为该论文共同通讯作者,烟台新药创制山东省实验室李燕研究员为该研究的参与作者。该工作得到中国科学院、基金委、科技部等经费支持。
全文链接:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00273-3
参考链接:
http://cemcs.cas.cn/kyjz/202306/t20230625_6787905.html
(供稿部门:李燕课题组;供稿人:于健)
发育中心脏心内皮的细胞间遗传示踪
2023-07-24 18:25
心脏作为人体循环系统的重要器官,通过泵送血液发挥输送营养物质,氧气和代谢废物的作用,对维持人类生命活动至关重要。心血管疾病是一种严重威胁人类健康的常见病,为社会、家庭和患者个人带来沉重负担。内皮细胞和免疫细胞是心脏的重要组成部分,在心脏早期发育及成体损伤修复中发挥重要作用,因此阐明心脏内皮细胞亚群分布以及心脏免疫细胞发育起源对了解心脏早期发育具有指导意义。
烟台新药创制山东省实验室李燕课题组参与了中国科学院分子细胞科学卓越创新中心周斌课题组的研究。在本项研究中,研究人员基于synNotch技术构建了synNotch配体工具小鼠与synNotch受体工具小鼠,利用细胞邻近标记技术(gTCCC技术)实现了对心脏内皮细胞亚群的谱系示踪。研究发现心脏内皮主要分为两群,一群属于心肌小梁层的心内膜,另一群为心肌致密层的血管内皮。通过对这两群内皮细胞亚群的发育谱系的探究,进一步发现心脏内皮细胞在发育过程不表现出造血潜能,而是形成冠状血管内皮细胞。研究成果“Intercellular Genetic Tracing of Cardiac Endothelium in the Developing Heart”于2023年6月22日发表于 Developmental Cell。

细胞与细胞通讯能够进行信号传递,功能调节等,是多细胞生物中基本的细胞行为。构建邻近细胞遗传谱系示踪新技术,阐明细胞与细胞之间的相互作用及邻近细胞谱系对解析生命活动及细胞机理具有重要意义。Notch信号通路属于经典的细胞之间交流通路,其主要依赖于邻近细胞之间的Notch配体与Notch受体结合,引起受体胞内段被γ-secretase切割,然后胞内段入核调控下游基因的表达。基于Notch通路工作原理,有研究构建了人工合成的Notch信号通路,称为Synthetic Notch(synNotch)(1)。通过在体外细胞水平表达人工合成的Notch配体与Notch受体,当配体与受体结合,就会诱导下游人工原件的激活,从而实现了细胞与细胞的邻近标记(1)。近期,周斌团队进一步地利用synNotch首次在哺乳动物体内创建了邻近细胞遗传示踪技术(gTCCC技术)(2)。此技术原理为,将Notch配体的胞外段替换为mGFP,而将Notch受体的胞外段替换为αGFP,Notch受体的胞内段替换为tTA,Notch受体的跨膜域保持不变,再结合tetO-on与Cre-loxP系统,当受体细胞与配体细胞接触时,就可以实现对受体细胞进行遗传标记。利用基于synNoth的细胞邻近标记技术,周斌团队揭示了胚胎早期心脏内皮向肝脏的迁移,以及在肿瘤生长过程中肿瘤血管内皮细胞迁移到肿瘤外包膜的现象(2),这展现了synNotch在体内邻近细胞研究方向具有重大应用前景。
心脏早期内皮主要分为两群,这两个亚群具有空间分布特点,第一群为最早在胚胎发育第8.0天(E8.0)左右出现的心管内皮细胞,称为心内膜;第二群为E12.5左右出现的心外膜下内皮细胞及其谱系。然而受于目前遗传工具的限制,还无法实现在体内对于这两种内皮细胞亚群进行特异性标记示踪。另一方面,有研究报道工具小鼠Nfatc1-Cre标记的心内膜属于生血内皮,在E9.5左右具有短暂造血活性,并且这些心内膜来源的血细胞能进入血液循环 (3, 4),然而Nfatc1并不是心内膜特异性分子标记,引起了领域内的争议。这一科学问题的解决需要建立心内膜特异性遗传工具进行细胞命运示踪。基于以上科学问题,本研究基于synNotch构建了多种邻近细胞标记技术实现了对心脏内皮细胞亚群的谱系示踪,并进一步探究了心脏发育期内皮细胞的造血活性。
首先研究人员利用已构建的Tnnt2-mGFP工具小鼠使心肌细胞表达synNotch配体,又构建了Nfatc1+细胞特异性表达synNotch受体的工具小鼠Nfatc1-αGFP-N-tTA(Nfatc1-antiGFP nanobody-Notch transmembrane domain-tTA)。研究发现在Nfatc1-αGFP-N-tTA中,Nfatc1除了在心内膜细胞表达,还表达在两种已知的卵黄囊(YS)和主动脉-性腺-中肾区(AGM)生血内皮细胞中,说明Nfatc1并不是心内膜特异性分子标记 (5)。然而在Tnnt2-mGFP;Nfatc1-αGFP-N-tTA;tetO-Cre;R26-tdT (CM-Endo-gTCCC)小鼠中,由于Tnnt2特异性表达在心肌细胞,所以只有与Tnnt2+心肌细胞接触的Nfatc1+内皮细胞才会激活synNotch信号,从而对受体细胞进行遗传标记。研究人员收取E16.5 CM-Endo-gTCCC胚胎并验证只有心脏内侧的Nfatc1+心内膜细胞被tdT标记示踪,免疫荧光染色及流式细胞分析显示这些被标记的心内膜并不会分化为心脏驻留型免疫细胞或外周血细胞,这些心内膜细胞主要分化形成冠状血管内皮细胞。
在E12.5左右,静脉窦来源的内皮细胞开始侵入心外膜下作为心脏第二群内皮细胞来源,这群内皮细胞在侵入心脏时可能会与心外膜发生相互作用,为了验证这一点并标记心脏外侧来源的内皮细胞,研究人员构建了心外膜细胞特异性表达synNotch工具小鼠Wt1-mGFP。然后对Wt1-mGFP;Cdh5-αGFP-N-tTA;tetO-Cre;R26-tdT (Epi-EC-gTCCC)小鼠心脏进行验证,发现在心脏发育中与心外膜接触过的内皮细胞被成功标记为tdT,这些细胞主要分布在心肌层外侧的致密层,研究人员也验证了这群心肌层外侧内皮细胞也不具备造血活性。为了更全面的验证心脏内皮细胞造血潜能,研究人员构建了Tnnt2-mGFP;Cdh5-αGFP-N-tTA;tetO-Cre;R26-tdT(CM-EC-gTCCC)工具小鼠并实现了对所有心脏内皮细胞无差别标记示踪(包括内侧和外侧内皮细胞),然而依然无法检测到心脏内皮细胞的造血活性。综上,研究人员利用synNotch构建了新的细胞邻近标记技术并成功实现了对心脏不同区域内皮细胞的遗传示踪,也进一步确认心脏内皮细胞在正常发育过程中不具备造血活性,为更准确地认识心脏早期发育、细胞起源及临床心脏损伤修复提供研究基础,也为心脏邻近细胞研究提供重要技术支持。


图注:利用synNotch构建细胞邻近标记技术
国科大杭州高等研究院生命与健康学院/中国科学院分子细胞科学卓越创新中心周斌研究组副研究员刘扩与中国科学院分子细胞科学卓越创新中心金恒薇博士为该论文共同第一作者,周斌研究员与刘扩副研究员为该论文共同通讯作者,烟台新药创制山东省实验室李燕研究员为该研究的参与作者。该工作得到中国科学院、基金委、科技部等经费支持。
全文链接:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00273-3
参考链接:
http://cemcs.cas.cn/kyjz/202306/t20230625_6787905.html
(供稿部门:李燕课题组;供稿人:于健)